人工知能(AI)はIoT(Internet of Things)と共に第4次産業革命の主要素であり、教育、防災、生活支援、ビジネス、看護福祉、農林水産、医療ヘルスケアなど多くの分野での応用が期待されている。
例えば、教育分野ではオーダメイド教育の提供、防災分野ではセンサやSNS情報を用いた被災状況の把握や予測、農林水産分野ではセンサやビッグデータに基づく精密農業の実現などが注目されている。ここでは、医療工学において、AIが何を可能としようとしているのかを概説し、その具体的な応用例を紹介する。
なお、AIの定義や、機械学習の手法についての詳細の議論は避け、一般の方や、医工学の境界領域の研究者らが新しい応用分野、応用方法を検討するための情報提供と位置付ける。
医療工学のための人工知能
人工知能で何ができるか?
厚生労働省「保健医療分野におけるAI活用推進懇談会報告書」において、人工知能の活用が期待される分野として、①ゲノム医療、②画像診断支援、③診断・治療支援、④医薬品開発、⑤介護・認知症、⑥手術支援があげられている。
人工知能の主要技術である教師あり機械学習では、入力と出力の組み合わせにより、そのAIシステムの機能を考えられる。特に、医療機関において日々の収集される臨床画像のビッグデータを基に、具体的な活用を考えると図1に示すような5種のAI医療機器が考えられる。
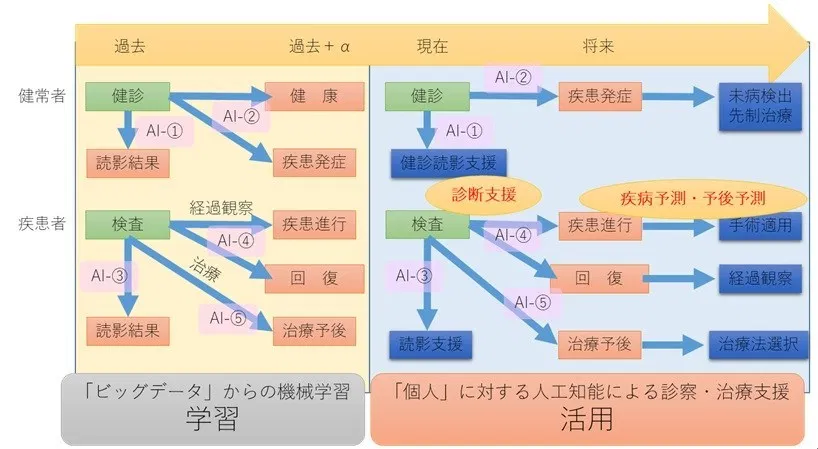 図1 臨床画像データを活用したAI医療機器の開発
図1 臨床画像データを活用したAI医療機器の開発
同図で、「過去」の時点、もしくはさらに「過去+α」において、多数個人より収集したデータを用いて学習することでAI医療機器を構築する。
学習済みのAI医療機器を用いることで、現在、未来の各個人の診察・治療支援を行う。AI-①とAI-②は主に健常者を、AI-③、AI-④とAI-⑤は主に患者を対象とする。また、AI-①と③は得られた検査データを医師が正確に安定して診断するためのAI支援を行い、AI-②、AI-④、AI-⑤は、将来予測に基づく診断や治療計画立案をAI支援する。
現時点でのほとんどの研究開発は、前者の診断の質向上に関するものであるが、将来の先制医療や予測医療を実現するための主幹技術として、後者の研究開発も今後は強く期待されている。以下に、各システムについて述べる。
AI-①では、健常者が受診した健康診断での検査データを入力、医師によるその検査結果を出力とする。検査結果とは、例えば胸部単純X線画像(いわゆるレントゲン画像)の正常・異常、脳MRA画像からの動脈瘤検出などが挙げられる。
本システムにより、健康診断画像の読影支援などが可能となる。下で述べるAI-③と並んで、健診データのAI診断支援はこの数年で大きく伸び実用化がすすめられる分野である。
AI-②では、AI-①と同じく過去のある時点で健常者が受診した健康診断での検査データを入力とし、ある一定期間後の同一個人の検査データや疾患の有無などを出力とする。
これにより、健康診断検査結果から一定期間後の健康状態や生活習慣病罹患などを推定する。本システムにより、健康診断の検査データからの将来の生活習慣病などの発症予測が可能となる。
AI-③では、患者の検査画像を入力、その読影結果を出力とすることで、患部の検出や、疾患の進行状況評価などを行う読影のAI診断支援を可能とする。
現時点では、同分野のAI医療機器開発が先行しており、例えば米国では糖尿病網膜症診断支援が米食品医薬品局(FDA)認可や、本邦では内視鏡診断支援がクラスIIIの医療機器(不具合の場合の人体リスクが比較的高い医療機器)として承認取得している。
AI-④では、患者にある検査後、経過観察対象となった患者データを対象とする。ここで、入力を同検査による検査結果、出力を一定期間の経過観察後の疾患状態とする。すなわち、患者に対して、一定期間後の疾患進行、回復などの症状を将来予測することで、医師による経過観察の可否判断を支援する。
AI-⑤では、患者の治療前の状態を入力、出力をその予後とし、治療による予後予測を行う。
同システムは、ある疾患に対して複数の治療法、治療薬、治療機器等の選択肢がある場合、各選択肢における予後予測に基づき患者の満足度や、治療後の生活の質に基づく選択を支援する。
読影分野での応用例
脳ドックMRA画像から脳動脈瘤の自動検出
AI-①のAI読影診断システム例として、脳ドックにおける脳MRA画像からの動脈瘤検出支援について紹介する。
脳ドックでは、MRI、MRAなどの検査画像を用いて、脳血管などの動脈硬化、動脈瘤等の脳疾患リスクや脳痴呆症の早期発見を目的とする。脳MRA画像とは、MRI装置を用いて脳血管を高輝度に描出した画像で、脳血管構造や血管形状の診断に有効である。
同画像を用いて未破裂脳動脈瘤の検出が行われているが、①対象が健常者で無症状であるため動脈瘤の有無や場所が予測できない、②発生初期の小さな動脈瘤を対象とする、③3次元的な形状評価が必要、④頭部全体で100枚以上の断層画像が撮影される、などの問題点が原因で、動脈瘤の見落としが発生しうる現状である。
構築システムは、解析対象となる個人の頭部MRA画像に対して、以下の手順で医師による脳動脈瘤検出をAI支援する。
図2に処理の流れを示す。このように多くのAI読影診断支援は、画像に対しての前処理、特徴量抽出、機械学習による識別で構成される。なお、深層学習のように、特徴量抽出と機械学習を合わせて行う手法も最近よく用いられている。
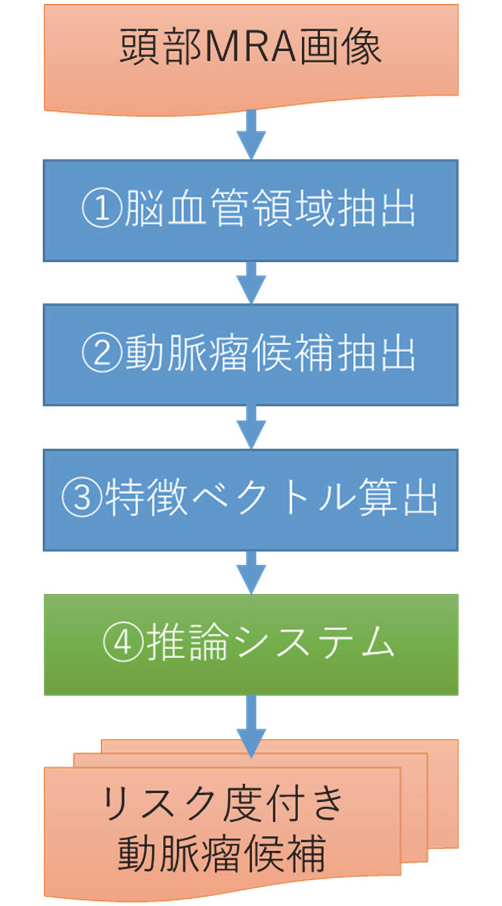 図2 人工知能による動脈瘤検出支援
図2 人工知能による動脈瘤検出支援
①頭部MRA断層画像(頭部全体で100枚以上)から脳血管領域を自動抽出する(図3)。
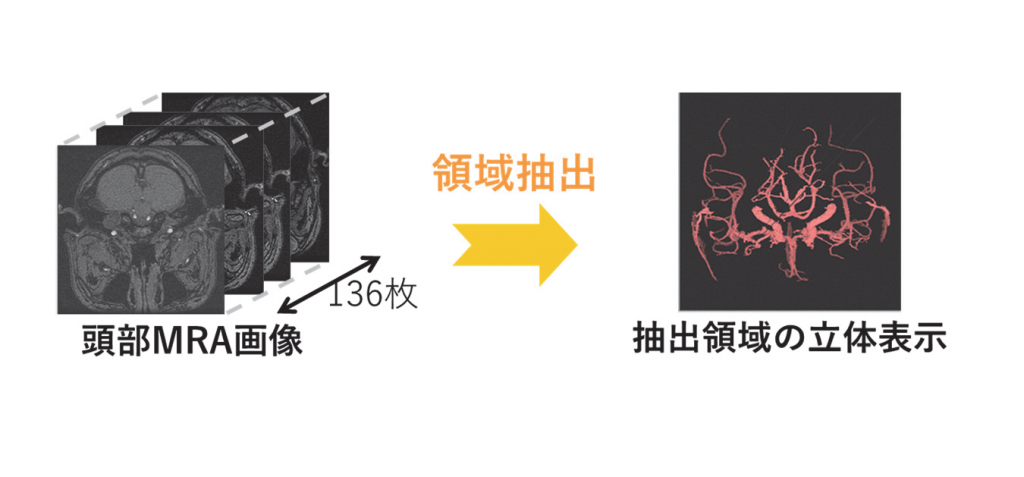 図3 血管領域の自動抽出
図3 血管領域の自動抽出
②図4に3次元的な脳血管領域からの動脈瘤候補の検出方法を示す。図5に示すように脳血管3次元領域から、推定正常脳血管3次元モデルを差分することで、脳動脈瘤候補群を求められる。
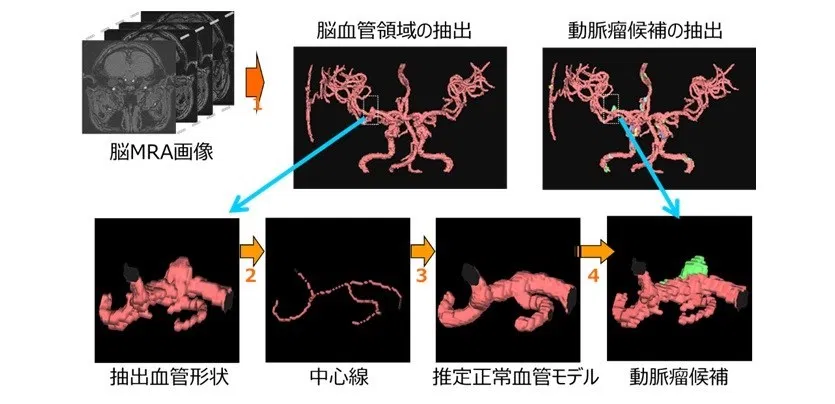 図4 動脈瘤候補検出の流れ
図4 動脈瘤候補検出の流れ
 図5 動脈瘤候補検出
図5 動脈瘤候補検出③各脳動脈瘤候補に対して、形状・信号値特徴量を求める。特徴量は以下の4種類の特徴量を用いる。
特徴量1: 距離値分散度
図6に示すように候補領域の参照軸からの距離値の分散で定義され、正常血管に平たくへばりつく偽動脈瘤候補や、尖がった偽動脈瘤候補などを除外する特徴量である。
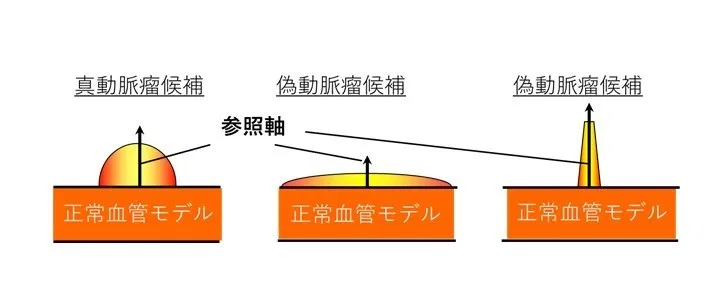 図6 特徴量1 距離値分散度
図6 特徴量1 距離値分散度
特徴量2: 半球度
動脈瘤は図6の真動脈瘤候補に示すように、半球形状を持つものが多い。そこで、
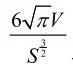
で求められる値を半球度と定義する。ここで、Vは候補体積、Sは候補の表面積である。完全な半球形状の時、同特徴量は1となる。
特徴量3: 平均信号値
MRA画像中において、動脈瘤は高い信号値を有する。そこで、候補領域の平均信号値を特徴量とする。
特徴量4: 3次元曲率
MRA画像中の信号値の3次元分布を評価するため、Shape index(SI)、curvedness (CV)で求められる値を特徴量として用いる。各特徴量の算出法はKoenderink. JJ. (1990)を参照。
④ ③で定義された特徴量(計5次元)を用いて、推論システムにより動脈瘤候補の真偽を判別する。
ここではその一例として、放射線科医により動脈瘤か否かを判断された多くの学習データを用いた最近傍法 (NN: Nearest Neighbor method)システムによるものを紹介する。学習データには、真と判断された動脈瘤候補(TP候補とよぶ)、偽と判断された動脈瘤候補(FP候補とよぶ)、それと各動脈瘤候補の5次元特徴量ベクトルが含まれる。
下記は、各動脈瘤候補に対して適用する。
ステップ1: 評価する動脈瘤候補に対して、③で定義する全特徴量を算出する。
ステップ2: 5次元の特徴量空間において、学習データにおいてマハラノビス距離(通常のユークリッド距離に非対角的相関を含めて一般化したもの)で最近傍となるTP候補、FP候補を一つずつ選択する。ここで、評価候補からTP候補、FP候補へのマハラノビス距離をそれぞれdT、dFとする。
ステップ3: 次式で、真の動脈瘤である所属度μを求める。
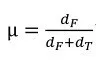
同所属度μは0から1の値を取る。すなわち、学習データ中で類似した特徴量ベクトルを持つ動脈瘤候補を求め、それがTP候補に近ければ高い所属度に、FP候補に近ければ低い所属度となる。
以上の処理を、対象被験者のすべての動脈瘤候補に対して適用する。得られた所属度が任意のしきい値以上となる動脈瘤候補を降順(すなわち高リスク順)に医師に提示することで、医師による動脈瘤検出を支援する。
将来の展望
この1、2年、人工知能に基づく医療機器の責任所在や開発ガイドラインなどが多く議論され、人工知能を活用した医療機器のFDA承認や本邦の薬事承認が始まっている。承認された機器は、医師の画像診断を支援するもので、今後は同機器が多く臨床現場に入ることで、医師や患者の反応とその活用方法、そして機器自体の改良へのフィードバッグについて注目されている。今後、同分野での医療機器開発が拡大することは疑問の余地はない。
一方、予測医療、先制医療への人工知能の活用はまだ研究開発途上であり、まずはその技術確立が必須である。さらには、臨床現場における患者や医師らによるそれら予測法の活用方法や倫理的問題についても議論が必要である。
しかし、今後の少子高齢化に伴う先端的高度医療の必要性、医療費削減効果を考えると、今後の医療の進歩の方向性は間違いなく予測医療、先制医療であり、そこでの人工知能の役割は非常に大きい。
さらには、医療分野では多くの人工知能の活用が可能で、期待されている。特に、画像関係においても、画像撮影に関しては、MRI装置、CT装置、超音波装置などの人工知能による自動撮影、撮影パラメータ自動最適化、カルテや他検査結果と協働した検査・診断・治療の支援なども進められている。
また、在宅での家庭向け医療機器による検査結果などのパーソナルヘルスケアレコード(PHR)、スマートフォンなどでの活動量計測結果の活用、カメラ撮影画像による簡易検査なども大きな研究分野であり、様々な医療機器、家庭用医療機器の開発が期待される。